훈트의 법칙 또는 훈트의 최대 다중성 법칙 에너지 궤도에서 전자의 쌍을 다루는 화학의 규칙이다.
우리는 모두 아우프바우 원리가 가장 낮은 에너지 궤도가 먼저 채워지고 그런 다음 더 높은 에너지 궤도로 이동하는 방식에 대해 이야기한다는 것을 알고 있습니다. 그러나 문제 이 규칙에 따르면, 우리가 알다시피, 각각의 서브쉘에는 p 오비탈이 3개, d 오비탈이 5개, f 오비탈이 7개 있습니다. 이 규칙은 이러한 오비탈의 채우기 순서를 논의하지 않습니다. 이 문제는 Hund의 규칙에 의해 해결되었으며, 이 규칙은 1925에 의해 프리드리히 훈트.
훈트란 무엇인가‘s 규칙?
규칙에는 다음과 같은 내용이 명시되어 있습니다.
- 하위 껍질의 모든 궤도는 궤도가 이중으로 채워지기 전에 먼저 단일로 채워집니다.
- 단일 점유 궤도에 있는 모든 전자는 동일한 스핀을 갖습니다.
훈트의 법칙을 설명하다
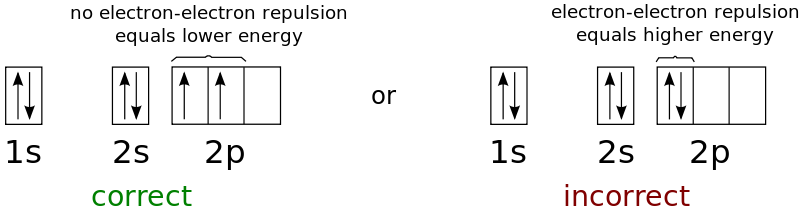
에 따르면 규칙의 첫 번째 부분전자는 항상 ~에 들어간다 빈 궤도 그들이 짝을 이루기 전에. 전자는 음전하를 띠기 때문에 서로 밀어내기 때문에 처음에는 가능한 한 멀리 떨어져 있고 싶어할 것입니다.
에 따르면 규칙의 두 번째 부분단일 점유 궤도의 짝을 이루지 않은 전자는 같은 스핀첫 번째 전자의 스핀이 선택되면, 해당 하위 레벨에 있는 나머지 전자의 스핀은 첫 번째 전자의 스핀에 따라 달라집니다.
즉, 최대 다중성의 훈트 규칙은 다음과 같다. 스핀 다중도의 가장 큰 값은 가장 낮은 에너지 항을 갖는다같은 에너지 레벨을 갖는 두 개 이상의 궤도가 비어 있으면 전자는 쌍으로 채워지기 전에 개별적으로 궤도를 채우기 시작합니다.
에서 파울리의 배타 원리동일한 시스템 내에서 두 개의 전자가 동일한 양자수 집합을 공유할 수 없다는 것을 알 수 있습니다. 각 공간 오비탈에는 두 개의 전자만 들어갈 수 있는 공간이 있습니다.
이들 전자 중 하나는 m을 가져야 합니다.에스 = ½ 그리고 다른 하나는 m에스 = -½. Hund의 규칙에 따르면, 서브쉘의 궤도는 이중 점유가 발생하기 전에 평행 스핀 전자로 단독으로 점유됩니다. 따라서 단독 점유 궤도에 존재하는 전자는 다음을 소유합니다. 동일한 스핀.
예
예를 들어, 탄소 원자는 다음과 같은 전자 배열을 갖습니다. 1초22초22p2. 동일한 궤도는 다음에 의해 점유됩니다. 2초 전자는 다른 궤도에 두 개가 차지됩니다. 2p 전자.
자주 묻는 질문
Hund의 최대 다중도 규칙은 스핀 다중도의 가장 큰 값이 가장 낮은 에너지 항을 갖는다고 말합니다. 같은 에너지 레벨을 가진 두 개 이상의 오비탈이 비어 있으면 전자는 쌍으로 채워지기 전에 개별적으로 차지하기 시작합니다.
아우프바우 원리는 전자가 높은 에너지 궤도를 채우기 전에 낮은 에너지 궤도를 채운다는 것을 말합니다.
관련 주제:




